Sintesi Proteica
(di Alessandro Locati BodyBuilding Italia)
<< introduzione
Le Strutture delle Proteine
La seguenza di aminoacidi in un polipeptide costituisce la sua struttura primaria.
La gran parte di queste proteine non si trova sotto forma di catene rettilinee ma ripiegate e avvolte in modi particolari formando così delle strutture particolarmente compatte atte a svolgere le proprie funzioni biologiche senza ulteriori apporti energetici o altre reazioni. Questi ripiegamenti conferiscono alla proteina la sua struttura secondaria e terziaria.
I ripiegamenti della catena proteica sono determinati dalle caratteristiche dei gruppi laterali R dei singoli aminoacidi (Fig1), questi gruppi R si caratterizzano a seconda che siano idrofobici o idrofilici (respinti o attratti dall'acqua) ionizzati con cariche positive o negative. Le ripiegature (la struttura secondaria) sono dunque il risultato dell'interazione tra le suddette caratteristiche; gli aminoacidi idrofilici tenderanno a stare all'esterno e vicino all'acqua, mentre quelli idrofobici tenderanno a stare all'interno e lontano dall'acqua, gli aminoacidi con cariche opporte tenderanno ad avvicinarsi mentre quelli con carica uguale tenderanno a respingersi.
Alcune molecole proteiche sono il risultato della combinazione di più catene polipeptidiche, a volte due o più copie di catene polipeptidiche si associano per originare una aggregato molecolare come avviene ad esempio nelle fibrille di collagene dei tendini, dove molti polipeptidi identici si associano formando triple eliche. Queste strutture complesse multi-polipetidiche sono dette quaternarie.
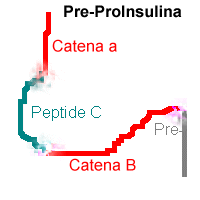
La proteina secreta dalle cellule beta del pancreas, ossia l'insulina, è una proteine a struttura quaternaria, formata da due catene di polipeptidi, le catene A e B unite da ponti di disolfuro. Le modalità di sintesi dell'insulina furono chiarite dal Dr. Steiner (1960) il quale scopri che l'insulina veniva sintetizzata come parte di una proteina più grande (proinsulina). In realtà i ribosomi non sintetizzano nè insulina nè proinsuilina, ma una molecola ancora più grande che funge da precursore, la Pre-ProInsulina (ossia la proinsulina con una breve sequenza aminoacidica supplementare). Successivamente la pre-proinsulina viene scissa, ad opera di alcuni enzimi prodotti dai ribosomi, prima in proinsulina e poi slegandola dal peptide C di collegamento (quello che collega le catene A e B) in insulina.
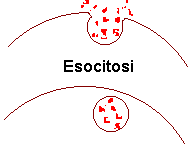
A questo punto l'ormone insulina è sintetizzato e immagazzinato in granuli adiacenti alla membrana interna della cellula. In risposta ad uno stimolo appropriato, come l'aumento del glucosio nel sangue, le membrane dei granuli si fondono con la membrana cellulare e le catene di insulina sono libere di entrare nel circolo sanguigno.
Tra le funzioni più importanti svolte dall'insulina vi è la regolazione del glucosio nel sangue.
Questo meccanismo di regolazione viene diretto dall'insulina, (ormone prodotto dalle cellule beta del pancreas) che “forza” il glucosio ad essere immagazzinato come glicogeno nel fegato e nei muscoli. Vedi il ruolo del glicogeno muscolare.
Quindi, la secrezione (o una iniezione) di insulina aumentano la formazione di glicogeno a spese del glucosio, e abbassano il glucosio presente nel sangue.
Si dice quindi che l'insulina ha un potere ipoglicemizzante; in risposta ad un innalzamento del glucosio sierico l'insulina abbassa tale percentuale di glucosio nel sangue (abbassa la glicemia). A dire la verità il tasso di glucosio è influenzato da una complessa e varia serie di fattori. Vi sono diversi ormoni che direttamente o indirettamente influiscono sul tasso di glucosio. Tra questi (sono solo esempi) vi sono il glucagone e gli ormoni prodotti dalle capsule surrenali.
Bibliografia essenziale:
The science 243 - 1988
A View of Life 34-35-36-37 (1981)